力学驱动消化道类器官构建及其机制研究
利用干细胞高效、高保真地构建消化道类器官,对研究人类消化道发育及疾病发生机理、推动干细胞疗法转化应用具有重要意义。目前,通过模拟早期胚胎肠管的发育过程,可诱导人多能干细胞在体外形成具有胃、肠、食道、肺等器官特征的一系列消化道类器官模型。然而,现有方法效率较低、可重复性差、难以进行标准化制备,且人们对调控消化道类器官形态发生的机制尚缺乏深刻的理解,严重阻碍了消化道类器官构建技术的发展及应用。
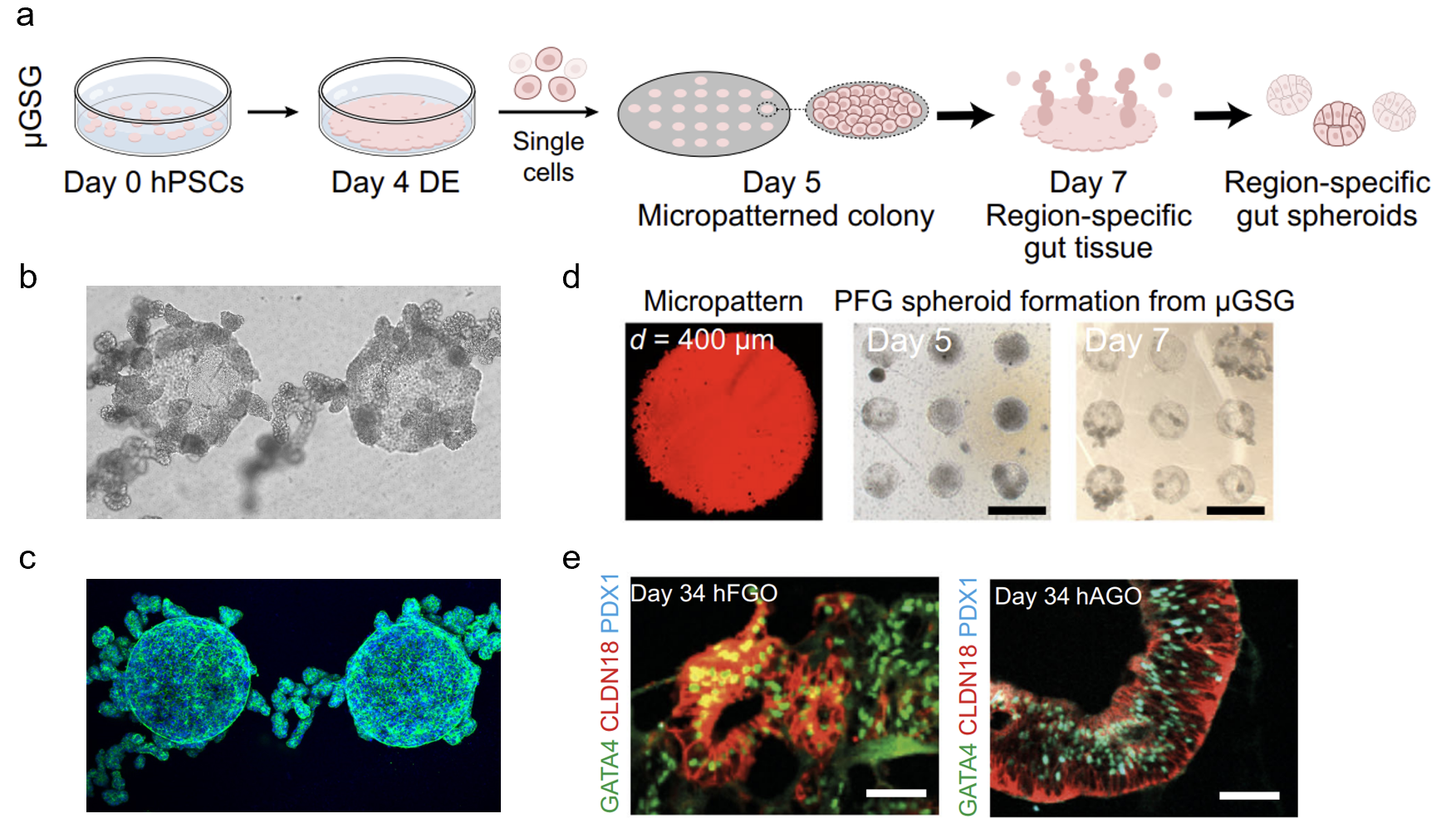
图1. 微限域培养驱动消化道类器官高效构建
(a)µGSG构建内胚层来源类器官的流程示意图;(b)类器官前体出芽发生的明场图;(c)类器官前体出芽发生的荧光图;(d)微图案荧光图及类器官前体发生过程的明场图;(e)对µGSG产生前体长时程培养(Day 34)的免疫荧光染色鉴定。
近日,我院生物力医学与力材料学转化团队联合清华大学航天航空学院在《自然通讯》(Nature Communications)在线发表了题为“力学增强的消化道类器官构建及其失稳驱动的形态发生机制”(Mechanically enhanced biogenesis of gut spheroids with instability-driven morphomechanics)的研究论文。该项工作报道了一种力学调控、通用、高效的消化道类器官构建体系µGSG(micropatterned gut spheroid generator)(图1)。该体系基于微限域培养方法,可以大幅提高胃、肠、肺、食道等多种区域特异化类器官的生产效率。利用µGSG所构建的类器官,具有和传统方法一致的仿生度,却突破了传统方法效率低、可重复性差、且无法标准化生产的瓶颈,或将有力促进消化道类器官构建技术的发展与应用。
进一步研究结果表明,µGSG提高类器官形态发生效率的机制不依赖于细胞培养的几何边界条件(即微图案的形状和尺寸),呈现出与传统理论不同的规律。通过结合实验观测和活性相场理论模型,发现通过机械力诱导的细胞聚集及多层堆叠是促进类器官高效生成的必要条件,并揭示了力学失稳(instability)是驱动由干细胞发育而来的消化道组织出芽(budding)、成球(pearling)、断裂(fission)的形态力学机制,成功预测了实验所观测到的单分散类器官形态,并利用生物力学相图刻画了组织表面张力调控的形态发生过程(图2)。总体上,这项工作揭示了组织表面张力和力学失稳调控组织形态发生的力-生物耦合新范式,为类器官构建与深入研究组织形态发生的机制提供了新方法和新思路。
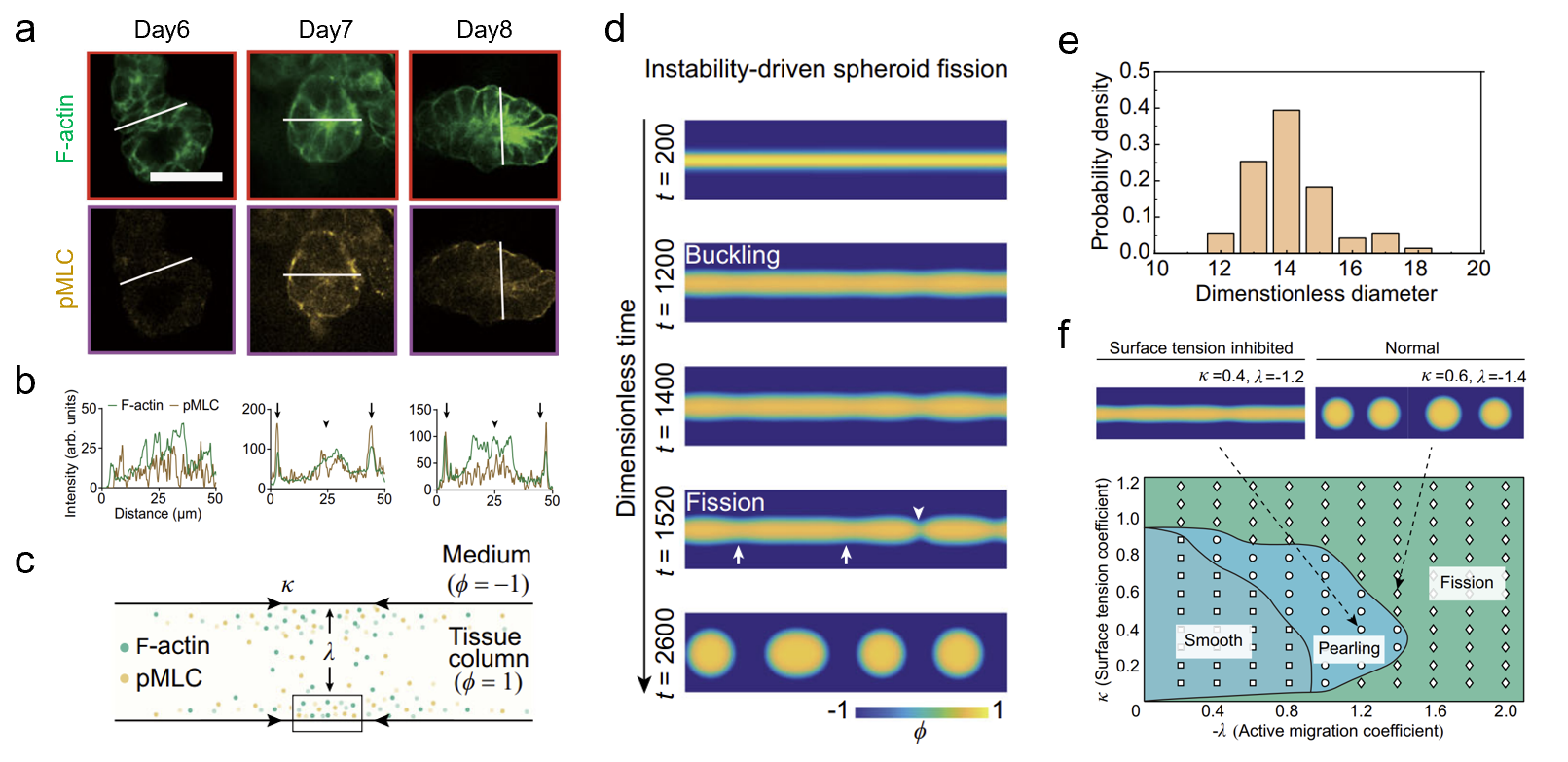
图2. 力学失稳驱动的类器官形态发生机制
(a)组织柱断裂前不同天数的细胞骨架免疫荧光染色图;(b)组织柱断裂前不同天数的细胞骨架的荧光分布统计;(c)前体球形态发生的活性相场模型示意图;(d)组织柱断裂产生前体球的模拟结果;(e)通过活性相场模型预测前体球大小;(f)前体球不同形态发生阶段的相场图。
我院生物力医学与力材料学转化团队林峰副研究员、清华大学航院博士后李夏、密歇根大学安娜堡分校博士研究生孙诗语、清华大学航院博士研究生李钟艺为论文的共同第一作者,清华大学航天航空学院邵玥副教授、李博副教授为论文的通讯作者。该成果得到了国家自然科学基金、国科温州研究院启动基金等资助。



